

期刊:Clinical and Translational Medicine
影响因子:6.8
通讯作者:苏宇雄、张高
通讯单位:香港大学
伯豪技术服务+产品:snRNA+空间转录组+转录组、伯优®细胞核分离试剂盒
科学问题
口腔鳞癌淋巴结转移过程中,肿瘤微环境中的细胞外基质重塑与免疫抑制如何协同驱动癌细胞扩散,其分子机制与关键靶点是什么?
实验材料和方法
1.患者队列与样本处理
分组:pLN⁺(淋巴结转移,n=10) vs pLN⁻(无转移,n=36)
样本类型:新鲜冷冻组织、FFPE切片、配对血液样本
2.多组学数据
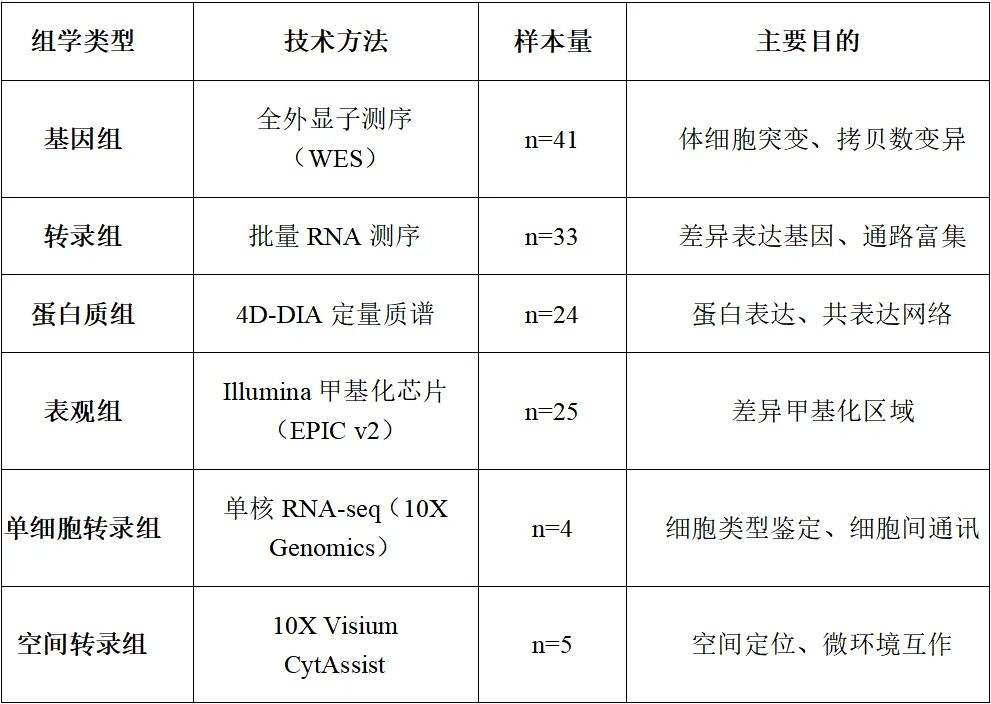
主要产品

导语
香港大学苏宇雄教授、张高教授团队在一项具有里程碑意义的口腔鳞癌研究中,借助伯优细胞核分离试剂盒提供的稳定、高质量的细胞核制备,成功对46例原发肿瘤(含10例淋巴结转移阳性样本)进行了系统性多组学整合分析,首次构建了涵盖基因组、转录组、蛋白质组、表观基因组、单细胞及空间转录组的全维度分子图谱。该研究不仅揭示了淋巴结转移相关的关键突变谱、细胞外基质重塑和免疫抑制微环境特征,更通过单细胞与空间技术,清晰解析了癌症相关成纤维细胞(CAF)通过分泌TGF-β配体激活癌细胞内信号、驱动上皮-间质转化(EMT)的空间协作机制。这些多层次的发现,系统阐明了口腔癌淋巴结转移的驱动网络,为早期识别高危患者及开发靶向治疗策略提供了全新依据,也凸显了可靠的上游工具对推动前沿癌症研究的关键价值。
主要产品
snRNA+空间转录组+转录组、伯优®细胞核分离试剂盒
(技术服务产品伯豪生物提供)
研究结果
1. 基因组层面:揭示pLN+的独特通路扰动
通过对pLN+和pLN−肿瘤的WES数据分析,研究发现两组的肿瘤突变负荷(TMB)和瘤内异质性(ITH)无显著差异(Figure S2A, B)。尽管TP53、TTN、CDKN2A等经典肿瘤驱动基因在两组中均有高频突变,但通路扰动分析(PMP评分)揭示了关键区别(Figure 2G)。
pLN+特异性通路:显著富集于“病毒蛋白与细胞因子/受体互作”通路,病毒模拟或细胞因子信号异常可能在pLN+的免疫调节中发挥重要作用。
pLN−富集通路:包括钙信号、B细胞受体、胰岛素和雌激素信号通路,这些通路的活跃可能与相对局限的肿瘤表型有关。
此外,在pLN+组中,与DNA修复(FANCA)、组蛋白修饰(KMT2A)、TGF-β(LTBP1)及MAPK(MAP3K14, MAPK1)等通路相关的基因突变更为突出(Figure 2D)。这些发现表明,pLN+肿瘤在获得性突变上已偏向于涉及基质互作、细胞可塑性和信号转导的特定通路。
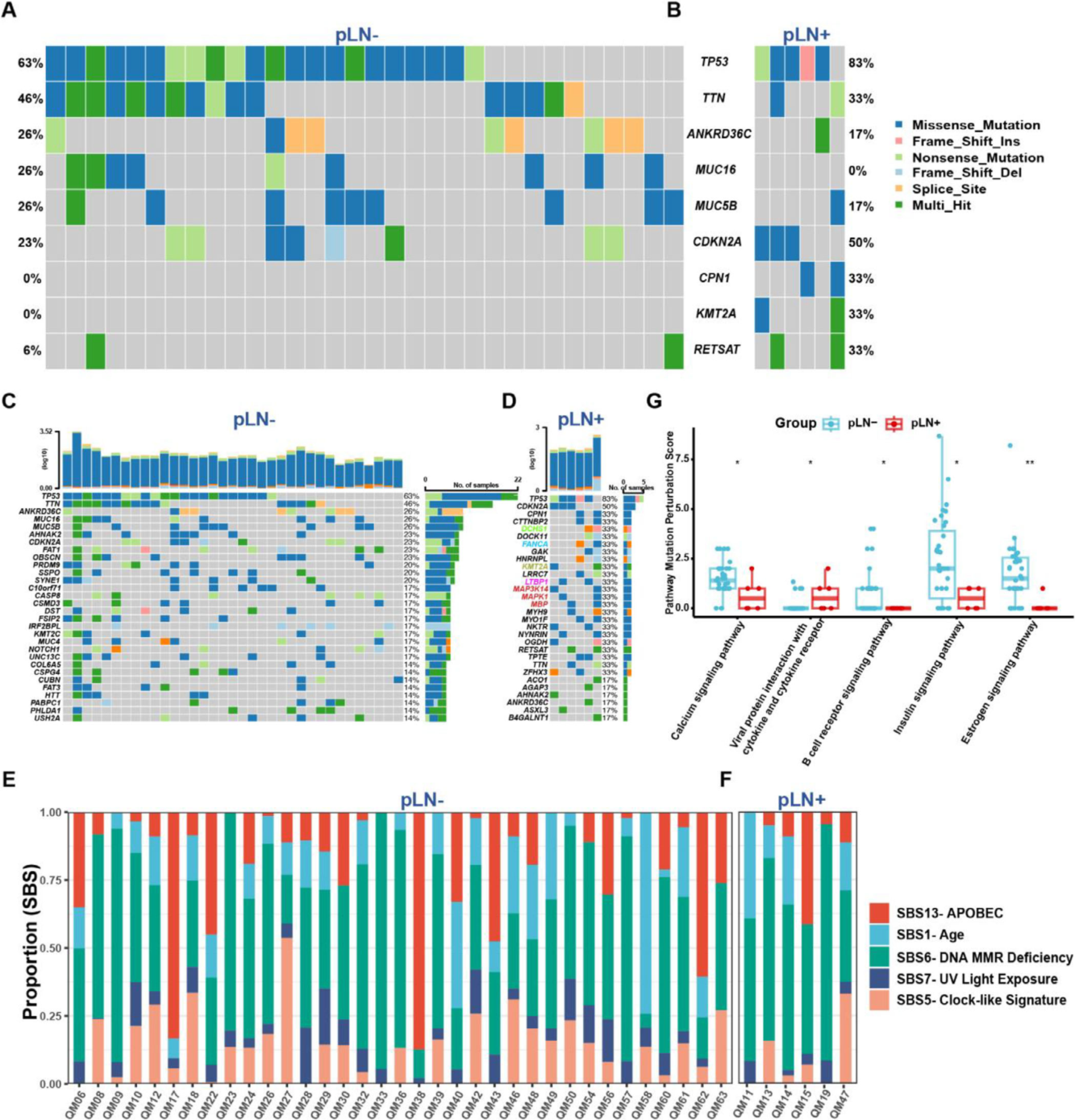
图2 伴有或不伴淋巴结转移的原发性OSCC的基因组图谱
2. 转录组与蛋白质组:共同指向ECM重塑与免疫抑制表型
转录组分析(Figure 3A-C)显示,与pLN−肿瘤相比,pLN+肿瘤显著上调了包括TGFBI、AGR2和AURKA在内的基因。GSEA分析进一步证实,pLN+肿瘤的特征是细胞周期(G2/M检查点、E2F靶基因)和DNA修复通路的强烈激活,而pLN−肿瘤则富集于角质化和脂代谢相关通路(Figure 3B)。尤为重要的是,免疫浸润分析(CIBERSORTx, xCell)结合免疫特征基因集富集发现,pLN+肿瘤表现出Th2细胞特征上调和免疫抑制相关(如 naïve CD4+ T细胞特征),这支持了pLN+ OSCC具有“免疫抑制”表型的假说(Figure 3A)。
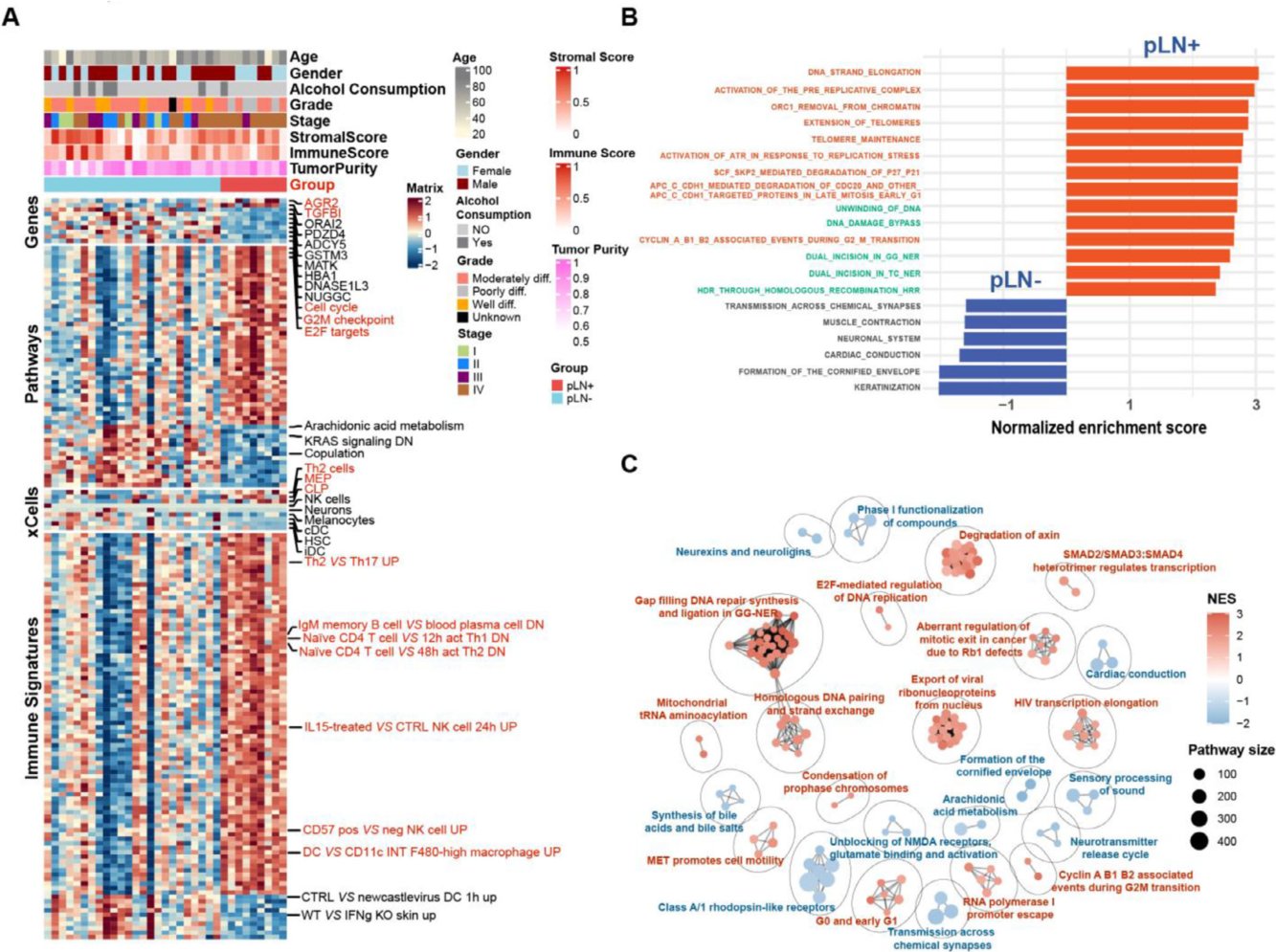
图3 pLN+与pLN−组的转录组学特征
4D-DIA蛋白质组学数据(Figure 4, S5)不仅验证了TGFBI等mRNA水平的变化,更通过加权基因共表达网络分析(WGCNA)发现了关键功能模块。在31个共表达模块中,ME11模块被鉴定为ECM相关核心模块,其蛋白(如FN1, POSTN, LUM, COL6A2, BGN)在pLN+肿瘤中高表达,且与患者不良预后、高复发风险和低分化等级显著相关(Figure 4E, F)。通路富集分析同样确认,ECM组织和整合素互作是pLN+肿瘤蛋白质组的标志性特征。
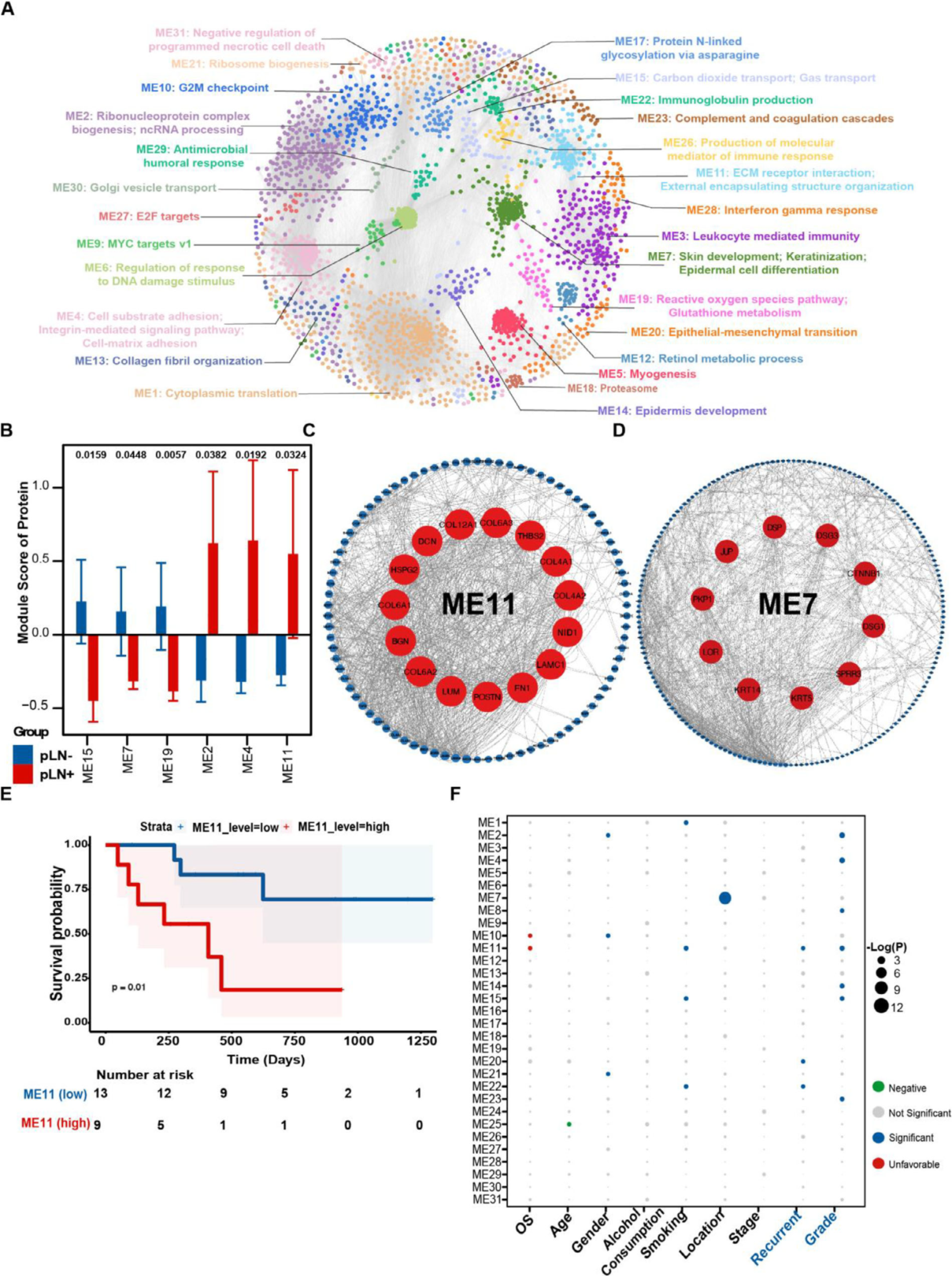
图4 蛋白质共表达网络及功能蛋白模块的临床相关性
通过整合mRNA与蛋白质表达谱的关联分析(Figure 5A-C, G),研究精准锁定了一个在pLN+肿瘤中一致性上调的关键枢纽分子——POSTN (Periostin)。其表达在转录与翻译水平均显著升高,且高表达与患者较差的总生存期明确相关。作为公认的基质细胞蛋白,POSTN是驱动细胞外基质组装并激活WNT、NOTCH等多条促瘤通路的核心因子。本研究中其枢纽地位的实验确认,从分子互作层面将POSTN置于连接“ECM重塑-信号通路激活-患者不良预后”这一网络的核心,为理解pLN+肿瘤的进展提供了关键锚点。
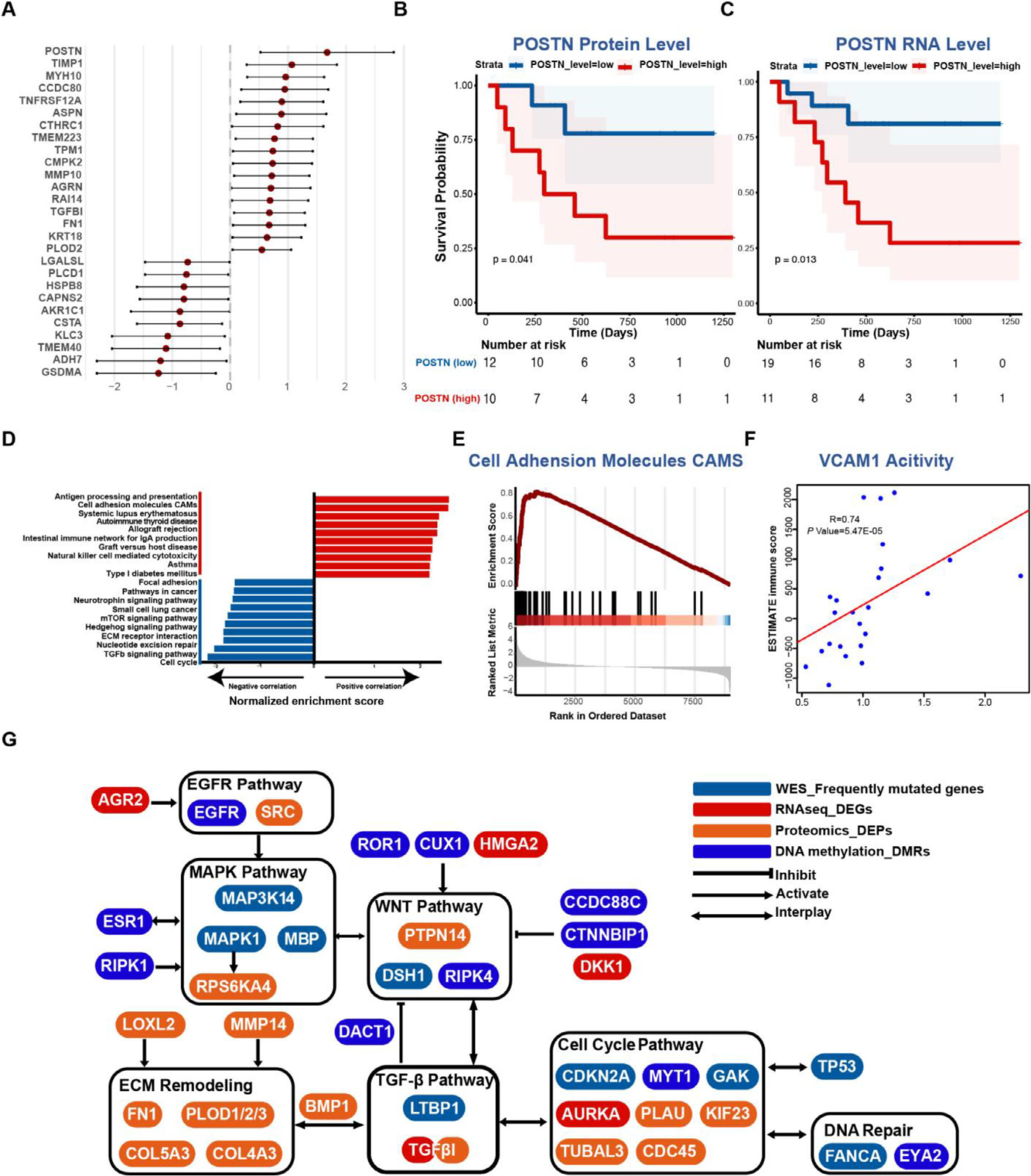
图5 批量肿瘤测序平台的整合分析
3. 表观基因组:EGFR通路的去甲基化激活
表观基因组分析进一步揭示了pLN+肿瘤的调控异常。DNA甲基化数据(Figure S6)显示,pLN+肿瘤中EGFR基因启动子区域呈现特异性低甲基化。这种常见的激活型表观遗传修饰,通常导致EGFR转录活性增强,可能进而持续激活其下游的MAPK等促增殖与存活信号通路,从表观遗传层面为pLN+肿瘤的高侵袭性提供了机制补充。
4. 单细胞与空间解析:CAF通过TGF-β“教育”肿瘤细胞
首先,单细胞图谱明确了关键信号的细胞来源。 通过对4例OSCC样本的22,433个细胞核进行分析,我们成功绘制了TME的细胞图谱,鉴定出上皮细胞、癌症相关成纤维细胞(CAFs)、内皮细胞、免疫细胞和神经元等主要群体(Figure 6A, B)。重要的是,表达分析显示,在蛋白质组学中鉴定的核心基质蛋白POSTN主要在CAFs中高表达,而促转移信号分子TGF-β1/2也显著富集于CAFs(Figure 6C, D; Figure S8C)。
其次,我们精准识别出与转移表型共存的肿瘤细胞亚群。 利用拷贝数变异分析,我们从上皮细胞中鉴定出5,099个肿瘤细胞,并划分为5个亚群(C0-C4)。分布分析显示,pLN+肿瘤主要由C0和C1亚群主导,而pLN−肿瘤则富含其他亚群(Figure 6E)。这两个优势亚群表现出独特的“TGF-βI阳性”表型:它们不仅高表达TGFBI基因,还富集于上皮-间质转化(EMT)和细胞周期(G2/M检查点, E2F靶标) 等相关通路,并且高表达TGF-β受体,构成了一个完整的、对TGF-β信号敏感的促转移细胞单元(Figure 6F-H; Table S5)。
接着,细胞通讯分析发现了pLN+特异的信号传递路径。 通过CellChat工具对细胞间相互作用进行推断,我们发现了一个关键且特异的信号模式:仅在pLN+样本中,存在一条从CAFs指向C0和C1肿瘤细胞亚群的强效TGF-β信号流(Figure 6I, J)。这从计算上证明了CAFs与特定肿瘤亚群之间存在功能性的旁分泌对话,而这种对话是pLN+肿瘤所特有的。
最后,空间转录组学为上述互作提供了原位的、可视化的铁证。 为了验证CAFs与C0/C1亚群是否在物理空间上具备互作条件,我们进行了空间转录组分析。结果清晰地显示,在pLN+肿瘤组织内,CAF特征、C0和C1亚群特征在空间上显著共定位,并且它们的表达水平呈强正相关;而在pLN−肿瘤中,这种共定位和相关性则缺失或为负相关(Figure 6K-N)。这无可辩驳地证实,在pLN+肿瘤中,分泌信号的CAFs与接收信号的“TGF-βI阳性”肿瘤细胞在解剖位置上紧密相邻,形成了一个驱动转移的“生态位”。基因集变异分析(GSVA)进一步显示,EMT通路在pLN+肿瘤的这些特定区域被显著激活(Figure S8G, H),将空间定位、细胞通讯与最终的功能表型完美衔接。
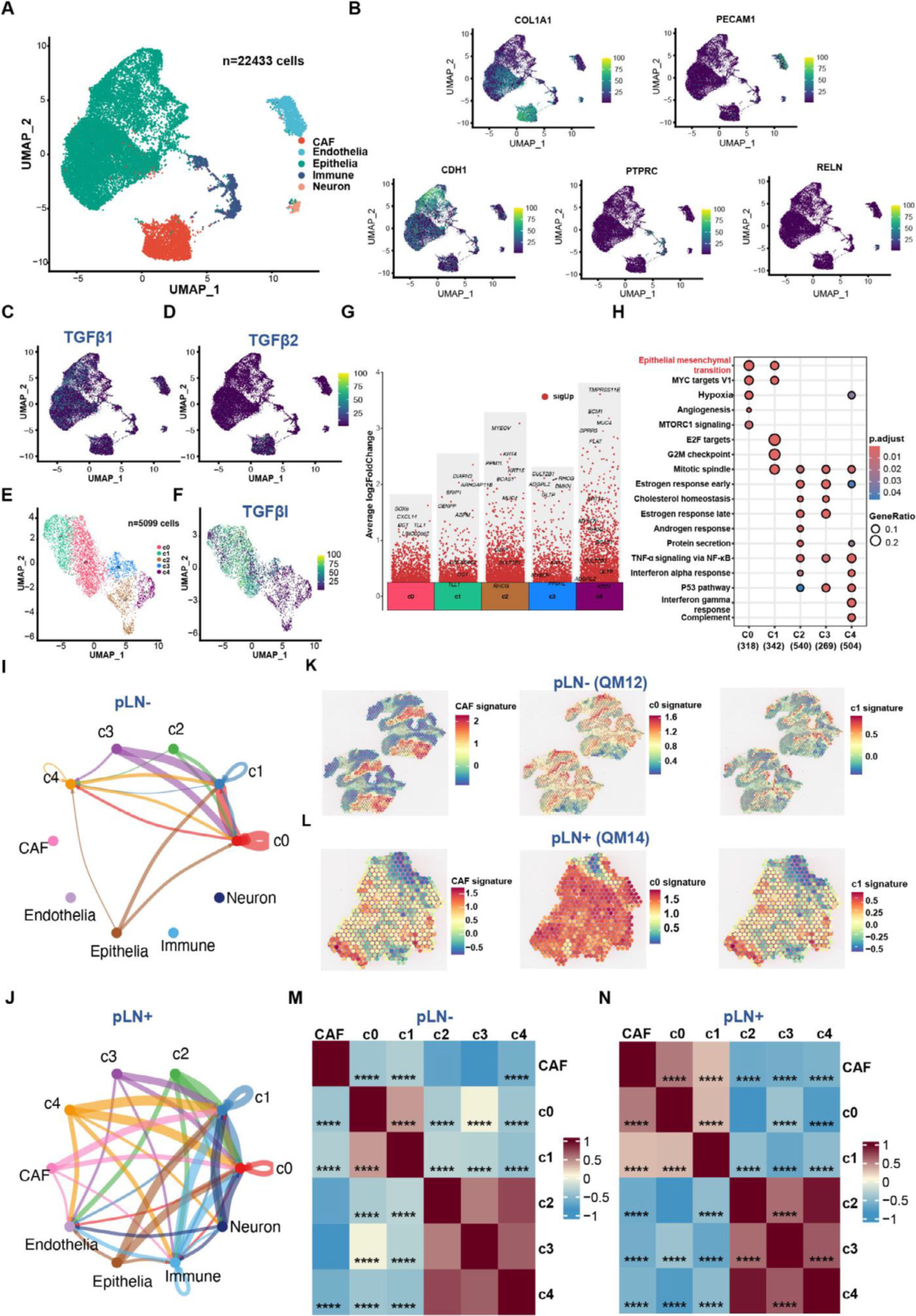
图6 单核与空间转录组学解析CAF来源的TGF-β旁分泌信号轴在空间生态位中对特定肿瘤细胞亚群EMT表型的驱动作用
结论
本研究通过整合蛋白基因组学、单细胞与空间转录组学,系统绘制了口腔鳞癌淋巴结转移的多维分子图谱。我们首次揭示,淋巴结转移并非孤立事件,而是由 “细胞外基质重塑-POSTN-TGF-β信号轴-免疫抑制微环境” 构成的动态网络所驱动的系统性病理过程。其中,单细胞与空间分辨技术清晰展现了 CAFs与特定“TGF-βI阳性”肿瘤细胞亚群在空间上形成功能单元,并通过 TGF-β旁分泌信号特异性驱动EMT 的关键细胞(Figure 5G, 6)。
这项工作将OSCC转移的研究视角,从肿瘤细胞内部的遗传变异,成功扩展至 “肿瘤细胞-基质细胞-免疫细胞”在三维空间中的互作生态。这不仅深化了对转移机制的理解,更重要的是,它指明了超越传统靶向治疗的新方向:未来针对OSCC淋巴结转移的治疗策略,或将聚焦于瓦解CAF与肿瘤细胞的致命联盟(如靶向TGF-β信号、POSTN或特定CAF亚群),并同步逆转免疫抑制微环境。本研究鉴定出的POSTN、TGFBI及“TGF-βI阳性”亚群等,为开发新型预后生物标志物和联合治疗策略提供了坚实的理论依据与潜在靶点。
参考文献:
Liu Y, Yang Z, Pu JJ, Zhong J, Khoo US, Su YX, Zhang G. Proteogenomic characterisation of primary oral cancer unveils extracellular matrix remodelling and immunosuppressive microenvironment linked to lymph node metastasis. Clin Transl Med. 2025 Mar;15(3):e70261. doi: 10.1002/ctm2.70261. PMID: 40038875; PMCID: PMC11879901.
本产品专为从动物组织中分离高纯度的单细胞核而设计。组织通过匀浆、裂解细胞膜等步骤释放完整细胞核,同时维持核膜稳定性及染色质空间结构,优化的密度梯度离心或离心管柱技术可进一步去除细胞碎片和杂质,从而可满足下游单细胞组学、表观遗传学等前沿研究领域对细胞核的质量要求。本产品突破传统解离法对样本活性的依赖,广泛适用于新鲜或新鲜冰冻组织,并兼容微量组织(<10 mg);全流程操作简捷,为复杂样本提供标准化的解决方案。
