肺的发育是多胚层协同调控的复杂过程,从胚胎期的肺芽萌发到成熟的分支网络形成,需要精准的信号分子调控和微环境支持。传统培养体系存在样本获取困难、培养时间有限、缺乏功能性血管等局限,从而制约研究进展。
hPSC技术的成熟为解决这些问题提供了可能——2025年6月30日,美国辛辛那提儿童医院的顾名夏团队、苗一非团队和郭敏哲团队合作在Cell杂志发表题为“Co-development of Mesoderm and Endoderm Enables Organotypic Vascularization in Lung and Gut Organoids”的研究论文。该研究首次通过人类诱导多能干细胞(iPSCs)成功构建了高度血管化的肺与肠道类器官。这一创新模型不仅模拟了人类胚胎早期多胚层协同发育的复杂过程,更突破了传统类器官缺乏功能性血管和器官特异性间质的瓶颈,为研究器官发育、疾病机制及再生医学提供了革命性工具[1]。
hPSC来源肺类器官特点
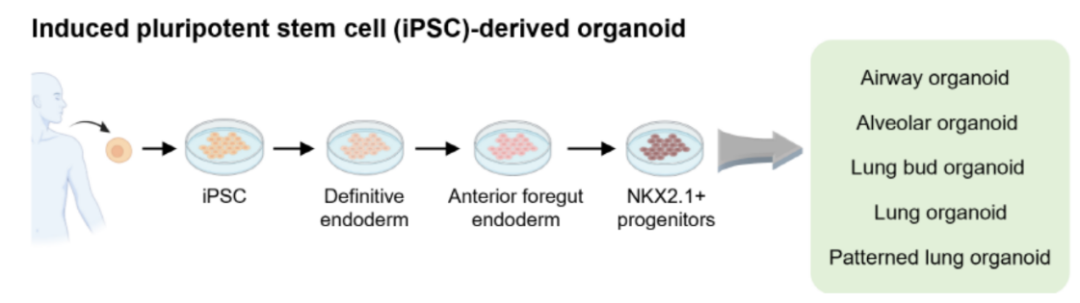
图1:iPSC来源诱导肺类器官[2]
核心优势
• 样本来源方便:hPSC可长期培养和扩增;
• 减少个体差异:细胞来源一致,减少类器官培养批间差异;
• 易于基因编辑:便于使用CRISPR等技术构建基因疾病模型;
• 可构建复杂模型:具备发育为包含血管、间质等多细胞复杂结构的能力。
应用场景
• 研究肺发育和早期疾病机制
• 构建遗传性肺病模型
• 大规模的药物筛选和毒性测试
维持更长时间,更广应用!
NovoDiffTM分支肺类器官培养试剂盒
可用于人ES和iPSC来源的分支肺类器官的生成和培养,独特的无血清配方适用于hPSC分化与分支肺结构功能的维持。NovoDiffTM操作简便,无需多次反复冻融,培养得到的类器官能够有效实现从多能干细胞向分支肺的分化,可广泛应用于基础研究、疾病建模、药物筛选与评价等领域。
-
长周期培养:已验证多种hPSC的分支肺生长和长期扩增(>2个月)
-
应用广泛:含有多种类型细胞,支持病毒感染、纤维化等研究
-
批次稳定:无血清,化学成分明确,确保实验可重复性
-
操作简便:无需反复冻融,配制方便,即用型培养基
hPSC来源分支类肺器官关键培养节点
以下将以NovoDiffTM试剂盒诱导培养出来的hPSC来源分支肺类器官为例,展示各阶段关键培养节点。
Day 1:拟胚体(EB)形态

图2:Day 1 EB形态
Day 2-Day 4:定型内胚层(DE)形态
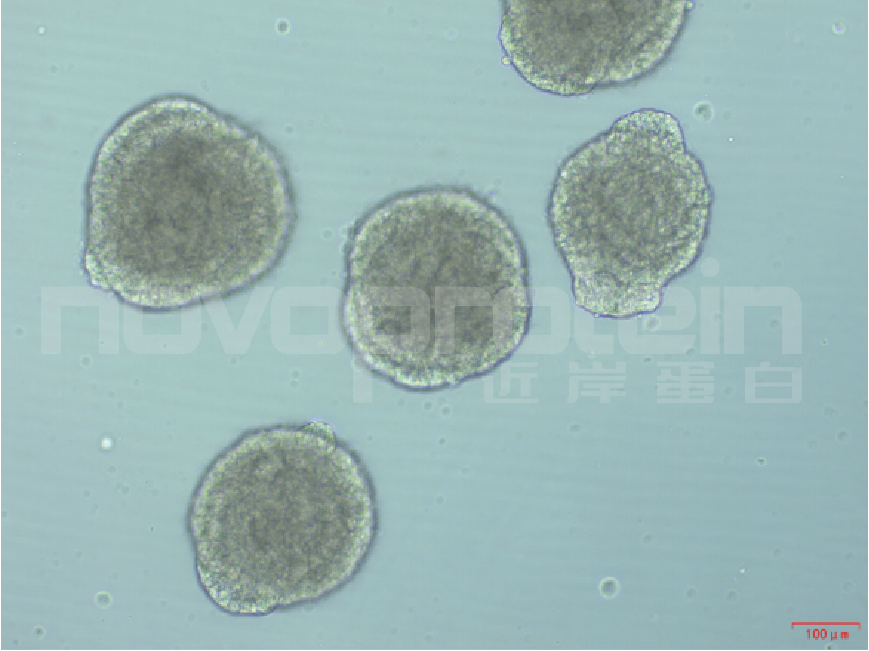
图3:Day 4 DE形态
Day 5-Day 6:前肠内胚层(AFE)形成细胞汇合度大于70%进入下一分化阶段

图4:Day 6 AFE细胞形态
Day 7-Day 14:肺芽类器官(LBO)形成
培养至Day 8-Day 9可见半漂浮状态的细胞团
培养至Day 14左右可见内部具有折叠结构的球体,即肺芽类器官
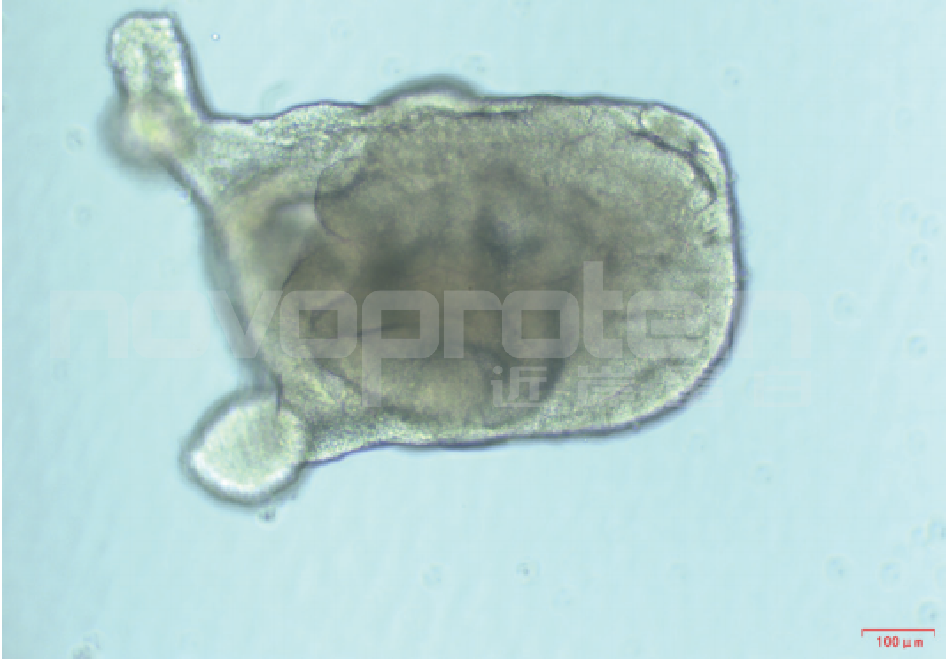
图5:Day 14 LBO形态
Day 15+:分支肺类器官成熟和长期维持
利用transwell持续培养分支肺类器官至成熟,类器官可用于后续下游实验使用

图6:Day 41 分支肺类器官形态
hPSC来源分支肺类器官鉴定
hPSC来源诱导出来的分支肺类器官含有多种肺脏细胞,可通过检测不同细胞的特殊标记物来鉴定分支肺类器官是否分化诱导成功。例如,可用免疫荧光方法从蛋白水平检测常见标记物:肺祖细胞(Pulmonary progenitor cells)标志物NKX2.1、肺泡Ⅱ型上皮细胞(AT2 cell)标志物SFTBP、COVID-19受体ACE2(图7)
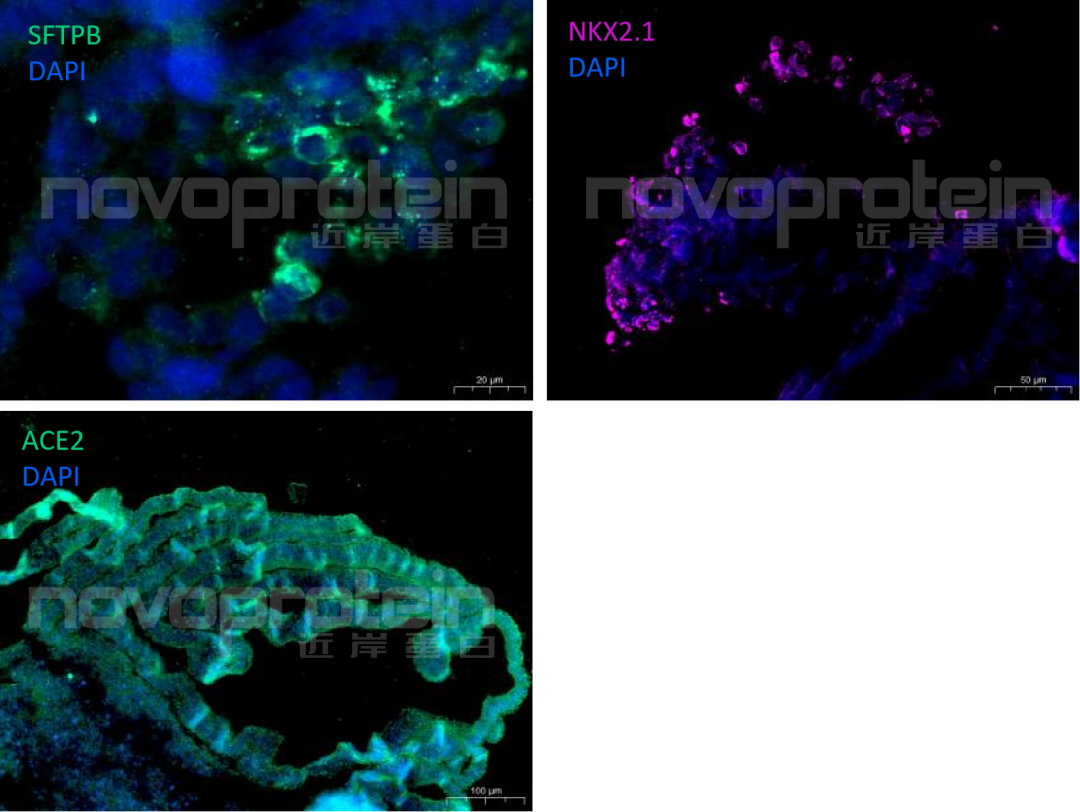
图7:NovoDiffTM试剂盒培养的hPSC来源分支肺类器官的免疫荧光图。DAPI(蓝)、SFTPB(绿)、NKX2.1(紫)、ACE2(绿)
可用RT-qPCR方法从RNA水平检测培养出来的分支肺类器官是否具有肺部远端到近端的分化诱导潜能标记物,如近端肺常见标志物MUC1、P63、FOXJ1,远端肺常见标志物SFTPB、SFTPC、ABCA3(图8)。
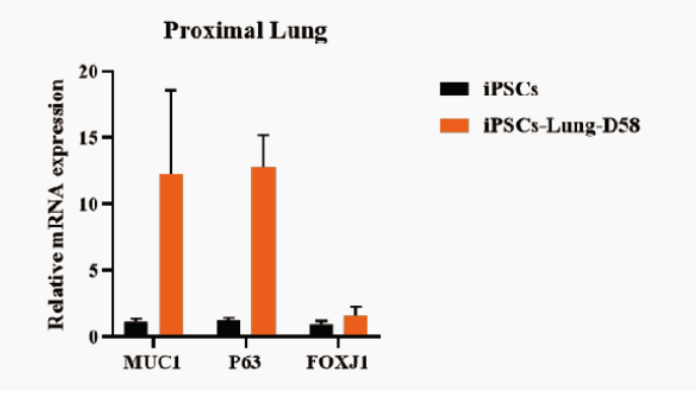
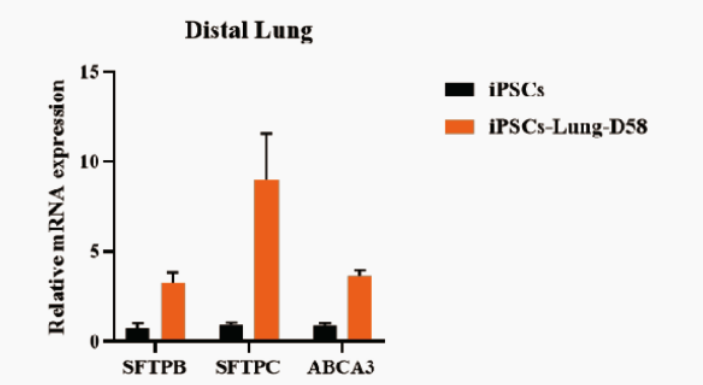
图8:分别对iPSC与NovoDiffTM试剂盒培养58天的iPSC来源分支肺类器官进行MUC1、P63、FOXJ1、SFTPB、SFTPC、ABCA3的RT-qPCR检测
hPSC来源分支肺类器官下游应用
含有多种类型细胞,可支持疾病模拟、药物筛选等研究,疾病模型包括肺纤维化、肺部感染等模型,下面展示的是NovoDiffTM试剂盒培养出来的hPSC来源分支肺类器官的肺纤维化模型构建情况。
博来霉素(Bleomycin)是一种用于构建动物肺纤维化模型的重要化合物,用Bleomycin处理后的hPSC来源分支肺类器官在形态上可明显表现出差异(图9),构建纤维化模型会引起衰老、炎症以及修复等生理活动,可进一步检测其衰老相关分泌表型( SASP )因子、肺泡前1型过渡细胞状态( PATS )标志物、炎症标志物和纤维化标志物的表达情况(图10)。

图9:处理Bleomycin和未处理(WT)的hPSC来源分支肺类器官明场形态对比
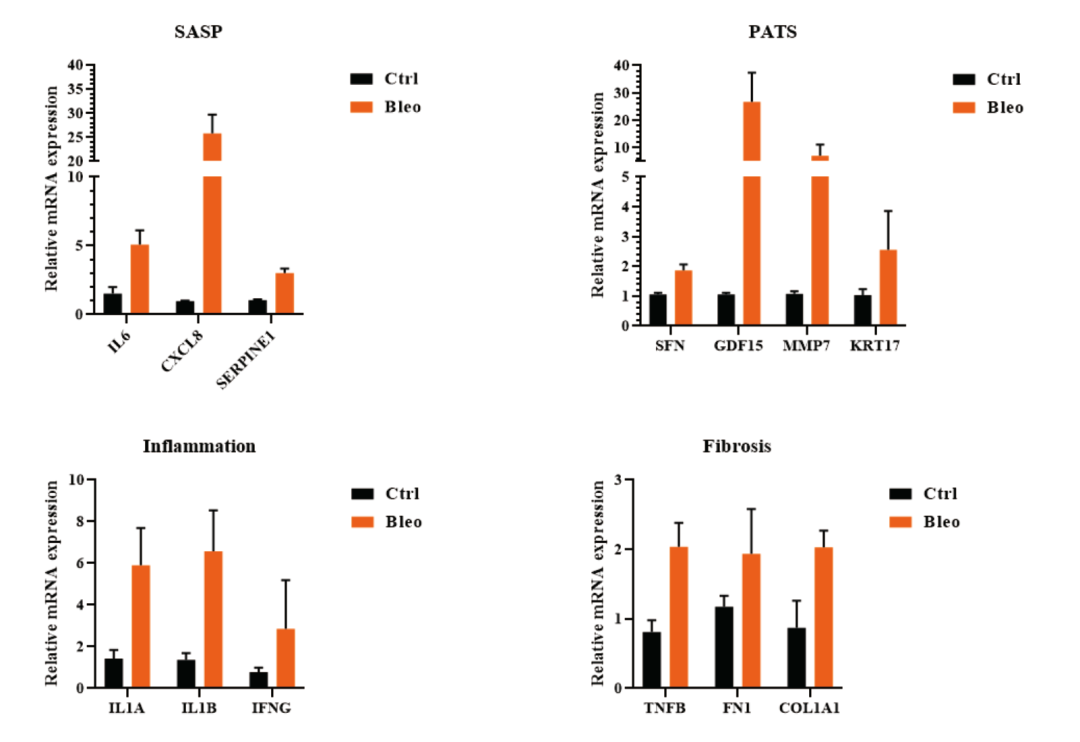
图10:处理Bleomycin的hPSC来源分支肺类器官进行RT-qPCR检测SASP、PATS、Inflammation和Fibrosis相关标志物表达情况
hPSC诱导类器官培养工具书,纸质版免费限时申领
-
9种hPSC来源类器官实验流程
-
提供经验证的细胞因子种类和使用浓度
-
不同培养阶段细胞/类器官实况图片
-
所需培养试剂组合推荐搭配
扫描下方二维码,获取NovoDiffTM分支肺类器官培养试剂盒更多产品信息及白皮书

参考文献
[1] Miao, Yifei et al. “Co-development of mesoderm and endoderm enables organotypic vascularization in lung and gut organoids.” Cell vol. 188,16 (2025): 4295-4313.e27. doi:10.1016/j.cell.2025.05.041
[2] Joe, Young Ae et al. “Experimental Mouse Models and Human Lung Organoid Models for Studying Chronic Obstructive Pulmonary Disease.” Biomolecules & therapeutics vol. 32,6 (2024): 685-696. doi:10.4062/biomolther.2024.148
